








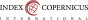

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Cílem studie byla analýza výsledků provádění screeningu vrozených vad (VV), geneticky podmíněných onemocnění (GPO) plodu a preimplantačního genetického testování embryí (PGT).
Metodika: Retrospektivní analýza zdravotních služeb u 2637 těhotných z období leden – prosinec 2022.
Výsledky: V rámci screeningu vrozených vad a geneticky podmíněných onemocnění plodu byla u 216 žen zjištěna abnormalita vyžadující další klinický management, u 15 (7 %) z nich byla diagnostikována vrozená vývojová vada plodu. Z 377 punkcí oocytů provedených v rámci IVF cyklu bylo preimplantační genetické testování (PGT) indikováno ve 48 (12,7 %) případech, u 19 (5 %) případů bylo PGT indikováno na základě geneticky podmíněného onemocnění (GPO).
Závěr: Screening vrozených vývojových vad a geneticky podmíněných onemocnění umožňuje následné řešení zjištěných patologií pomocí preimplantačního genetického testování embryí při plánování dalšího těhotenství či naplánování adekvátní prenatální diagnostiky v budoucím těhotenství.
Medicína se v současné době transformuje zásluhou souběžného pokroku dvou hlavních spolupracujících technologií. První představuje explozivní pokrok v informačních technologiích a druhá rychle se rozvíjející vědecké poznání v oblasti genetiky. Genetika se uplatňuje a potenciálně zasahuje do všech medicínských specializací, ale zejména je důležitá v otázkách reprodukce a ve všech pediatrických oborech. Poskytuje bezprecedentní možnosti prevence, protože většinu geneticky podmíněných onemocnění lze diagnostikovat dlouho před tím, než se objeví symptomy. Hlavní význam genetiky v klinické praxi je v osvětlování úlohy genetické variability a mutací v etiologii rozsáhlého počtu onemocnění. Prakticky každé onemocnění je výsledkem kombinovaného působení genů a prostředí, význam genetické komponenty může být variabilní. Genetické poradenství zahrnuje co nejpřesnější stanovení reprodukčního genetického rizika příslušného páru (5,9,10). Ke snížení rizika postižení dítěte může vést úprava diety nebo životního stylu matky nebo volba prenatální diagnostiky s možností přerušení těhotenství. Další možnosti mohou zahrnovat preimplantační testování, umělé oplodnění spermiemi dárce, darování vajíčka, nebo dokonce antikoncepci či sterilizaci kombinovanou s adopcí zdravého dítěte. Preimplantační testování embrya má několik variant: PGT-A – preimplantační testování chromozomálních aneuploidií, PGT-M – preimplantační testování monogenních chorob a PGT-SR – preimplantační testování strukturálních chromozomových aberací. Tyto varianty se liší indikacemi a provedením. Umožňují vybrat embryo s nejlepšími předpoklady pro normální vývoj, ale protože se vyšetřují buňky trofoektodermu, v důsledku mozaicizmu nemusí být nález ve zbytku embrya identický. Pro potvrzení se potom doporučuje ještě provedení prenatální diagnostiky (biopsie choria nebo amniocentéza) (2,3,4,5).
Metodika: Provedli jsme retrospektivní analýzu zdravotních služeb našeho zařízení u 2637 těhotných z období leden – prosinec 2022.
Výsledky: V období od ledna do prosince roku 2022 bylo provedeno celkem 2637 zdravotnických výkonů, z toho 957 kombinovaných screeningů v I. trimestru těhotenství (v 11. - 13. týdnu), 1168 podrobných hodnocení morfologie plodu ve II. trimestru těhotenství, 216 superkonziliárních ultrazvukových vyšetření v průběhu prenatální péče a 167 invazivních výkonů (odběr choriových klků, plodové vody). Ze 162 provedených aminocentéz v roce 2022 bylo 12 (7,4 %) případů provedeno z důvodu věku, 13 (8,1 %) s pozitivním ultrazvukovým nálezem, 25 (15,4 %) pro pozitivní anamnézu (osobní, rodinnou, translokace apod.) a ve 112 případech (69,1 %) z důvodu pozitivního screeningu v prvním trimestru. Odběr choriových klků byl z celkových 5 indikován ve třech případech pro pozitivní screening, v jednom případě pro pozitivní anamnézu a v jednom případě pro pozitivní prvotrimestrální screening.
V období od ledna do prosince roku 2022 jsme provedli 377 punkcí oocytů a z toho podstoupilo 48 párů preimplantační genetické testování embryí v rámci IVF cyklu. Důvodem ke genetickému vyšetření embryí byl věk žen nad 35 let (47,9 %), opakovaně neúspěšná léčba metodami asistované reprodukce včetně selhání implantace embryí (6,3 %), opakované těhotenské ztráty (6,3 %) a prekoncepčně zjištěné geneticky podmíněné onemocnění (39,6 %) (viz Tab. 1).

Grav. 4, Para 2, 39 let. OA: bezvýznamná. Abusus: kouření 10 cigaret denně. GA: menses pravidelně od 13 let/28/5 dní. Gynekologicky neléčena. V 1. těhotenství umělé přerušení těhotenství na žádost probandky, 2. těhotenství: spontánní porod, zdravé děvče 2850 g ve 38. tt. Ve 3. graviditě matka GDM na inzulinu, porod ve 30. tt. per SC pro suspektní abrupci placenty a polyhydramnion. Děvče 1530 g, 45 cm. AS 3-4-6, po vybavení atonie, intubována, surfaktant, pobyt na JIP, trvalá hospitalizace, těžký hypotonicko- apatický syndrom, UPV dependence, tracheostomována, porucha polykání, PEG, dle MR opožděná myelinizace CNS, EMG obraz smíšené demyelinizační a axonální léze na horních i dolních končetinách. V rámci genetického testování v průběhu hospitalizace provedeno chromozomální vyšetření, array CGH a MLPA vyšetření SMA – s normálními nálezy. Genealogické vyšetření: v širší rodině není žádná závažná genetická zátěž.
Molekulárně genetické vyšetření: analýza genů spojených s neuromuskulárním onemocněním. U probandky byly v genu CNTNAP1 nalezeny vzácné varianty c.987del a c.1456+1G>A v heterozygotním stavu. Jedná se o velmi vzácné varianty s predikovaným patogenním účinkem (frame-shift varianta s následnou zástavou produkce proteinu, splice site varianta s předpokládaným dopadem na sestřih mRNA). Zjištěné varianty byly v heterozygotním stavu následně potvrzeny u obou rodičů probandky. Výsledek vyšetření rodičů svědčí pro transpozici obou patogenních variant u probandky.
Patogenní varianty genu CNTNAP1 jsou spojovány s fenotypickou sekvencí kongenitální hypomyelinizující neuropatie 3/syndromem kongenitálních letálních kontraktur 7 (CHN3/LCCS7). Jedná se o autozomálně recesivní onemocnění s poruchou myelinizace, těžkou hypotonií, respirační insuficiencí, poruchami polykání, těžkou retardací psychomotorického vývoje a variabilním stupněm kontraktur (6,7). Nález je v souladu s fenotypem probandky. Onemocnění probandky se řadí mezi vzácná onemocnění s těžkým postižením psychomotorického vývoje a velmi závažnou prognózou.

Oba rodiče probandky jsou dle genealogie a výsledku molekulárního vyšetření přenašeči CHN3/LCCS7. Riziko přenosu patogenní varianty na potomky je u každého z nich 50 %, riziko postižení potomků tohoto páru je 25 %. V případě plánované reprodukce je možné nabídnout preimplantační/prenatální testování. Je zde indikace ke genetickému vyšetření příbuzných 1. stupně obou rodičů probandky.
Následně byla pacientka zařazena do programu IVF s plánem preimplantačního genetického testování embryí metodou karyomapping. Řízená ovariální stimulace byla provedena protokolem s použitím antagonisty GnRH. Pick up 13. den stimulace – punkcí folikulů získány 3 oocyty, které byly následně denudovány, fertilizovány a embrya byla kultivována v Embryoskopu (semipermanentní monitoring embryí do 5. dne vývoje). Biopsie trofektodermu byla provedena u jednoho embrya 5. den ve stádiu expandované blastocysty. Embryo bylo analyzováno metodou karyomapping a následně vyhodnoceno. Vzhledem k normálnímu genetickému profilu a vyloučení přítomnosti mutace v genu CNTNAP1 bylo embryo doporučeno k transferu (viz Tab. 4, Obr. 1, 2). Embryologická kvalita embrya byla 4BC, hodnoceno dle Gardnerových kritérií, kde B – embryoblast tvoří menší množství volně seskupených buněk a C – trofoblast je tvořen několika málo buňkami. Single embryotransfer byl proveden do estrogeny a gestageny připraveného endometria. Pozitivní hladina hCG byla stanovena 14. den po embryotransferu. Pacientka byla předána do péče obvodního gynekologa v 8. týdnu gravidity.
Grav. 3, Para 1, 37 let. OA: bezvýznamná, GA: menses pravidelně od 12 let/28/5 dní.
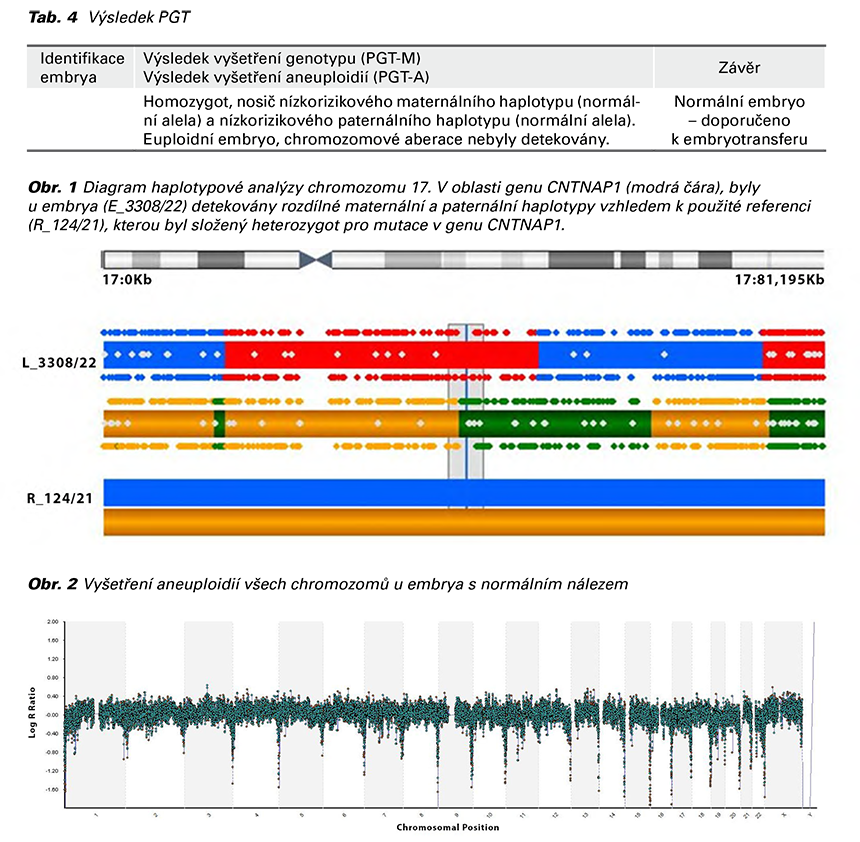
1. těhotenství spontánní koncepce, porod císařským řezem pro HELLP/preeklampsie, syn náhlé úmrtí v 5 měsících. 2. těhotenství – spontánní koncepce, spontánní potrat v 10. tt. 3. těhotenství – IVF/ICSI/ PGT (array CGH)/KET. Genealogické vyšetření: matka asthma bronchiale, vlastní sestra ulcerózní kolitida, dcera sestry spina bifida (na invalidním vozíku). Probandka a její partner nejsou v příbuzenském vztahu a jsou zdrávi. Výsledek cytogenetického vyšetření periferní krve: ženský karyotyp s balancovanou pericentrickou inverzí chromozomu 3 se zlomy v pruzích 3p25 a 3q21 (Obr. 3a, 3b). U partnera probandky cytogenetickým vyšetřením periferní krve zjištěn normální mužský karyotyp s normálním počtem a strukturou chromozomů.
Doporučení: Pro každé těhotenství je riziko vrozených vývojových vad a genetických onemocnění na základě empirických dat odhadováno okolo 3 - 5 %. Při nezjištěné příčině náhlého úmrtí kojence by měla vždy být vyloučena genetická příčina. Jednou z příčin může být nebalancovaná forma translokace, zděděná od fenotypicky zdravých přenašečů balancované translokace. Pro nosiče takové aberace je zde zvýšené riziko chromozomálních aberací, malformací plodu nebo dysfertility. Ze všech prokázaných těhotenství končí 15-20 % samovolným potratem. Závažné komplikace v graviditě (abrupce placenty, intrauterinní úmrtí plodu, těžká preeklampsie či těžká růstová restrikce plodu) jsou přítomné v cca 5 % všech těhotenství. Riziko opakování preeklampsie v další graviditě nad 60 % mají těhotné se zatíženou anamnézou: diabetes mellitus Typ I, chronická hypertenze, chronické onemocnění ledvin nebo výskyt preeklampsie v předchozí graviditě před 28. týdnem těhotenství. Riziko trizomie 21 vzhledem k věku probandky 37 let je přibližně 1/197 v termínu. Empiricky je genetické riziko pro plody z gravidit pomocí metod IVF mírně zvýšeno oproti plodům z přirozeného početí. Riziko vrozených vývojových vad a genetických onemocnění pro potomka páru je na základě empirických dat okolo 5 %.
Celkové riziko narození dítěte s nebalancovaným karyotypem se v případě přenašeče pericentrické inverze odhaduje na 5 až 10 %. Rozsáhlejší pericentrické inverze vedoucí k životaschopnému rekombinantnímu potomstvu jsou rizikovější než menší pericentrické inverze, protože u nich jsou nebalancované segmenty v rekombinantním potomstvu kratší než u větších inverzí (8). V případě probandky je zjištěná inverze na 3. chromozomu se zlomy v pruzích 3p25 a 3q21 relativně velká (cca 60 % celkové délky chromozomu), proto odhadované výše popsané riziko je mnohem větší. Údaje o spermatogenezi získané z této studie naznačují podobné účinky v oogenezi. U mužů s inv(3)(p25q21) byly zhruba ve 30 % spermií pozorovány nebalancované rekombinace (8, 9). U nosičů inverze inv(3)(p25q21) byly popsané opakované potraty a zvýšené riziko syndromických abnormalit. Postižené děti mají těžkou poruchu vývoje s vysokou mortalitou v prvních měsících života (1).
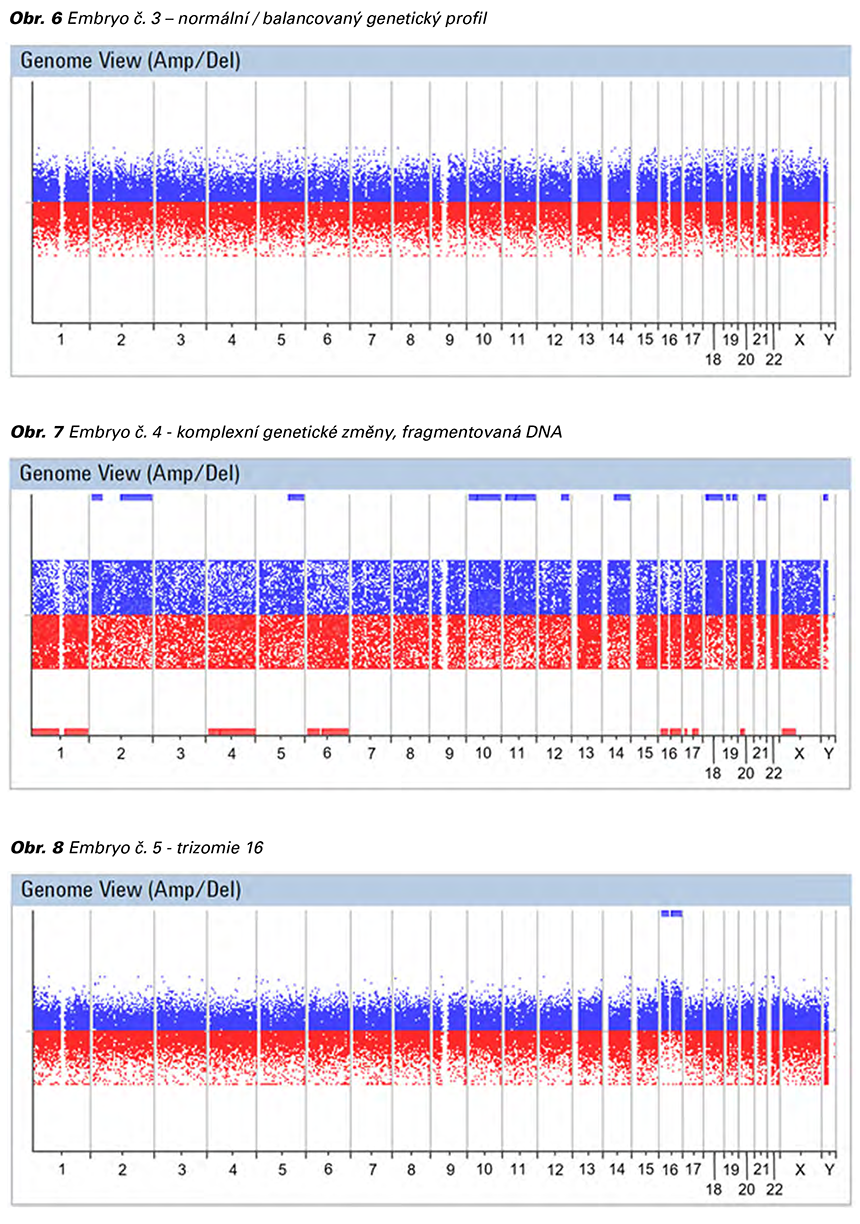
Na základě výše uvedených dat bylo doporučeno při plánování gravidity preimplantační genetické testování se zavedením zdravého embrya. Pacientka byla zařazena do programu IVF s plánováním preimplantačního genetického testování embryí metodou array - CGH. Řízená ovariální stimulace byla provedena protokolem s použitím antagonisty GnRH. Pick up proveden 12. den stimulace. Punkcí folikulů bylo získáno 7 oocytů, které byly následně denudovány, fertilizovány a embrya byla kultivována v Embryoskopu do 5. dne vývoje. Biopsie trofektodermu byla provedena u 5 embryí 5. den vývoje ve stádiu expandovaných blastocyst. Metodou array CGH bylo analyzováno a následně vyhodnoceno všech 5 embryí. Jedno embryo mělo normální nebo balancovaný genetický profil a bylo doporučeno k transferu (viz Tab. 5, Obr. 6). Embryologická kvalita embrya byla 4AB, hodnocení provedeno dle Gardnerových kritérií, kde A – embryoblast tvoří mnoho buněk, které jsou těsně spojené a B – trofoblast z méně buněk tvořících rozvolněný epitel. Single embryotransfer byl proveden do estrogeny a gestageny připraveného endometria. Pozitivní hladina hCG byla stanovena 14. den po embryotransferu. Pacientka byla předána do péče obvodního gynekologa v 8. týdnu gravidity.

Biopsie buněk trofektodermu byla provedena u 5 embryí. Následně byla provedena celogenomová amplifikace DNA. Všechna embrya byla analyzována metodou array CGH.
Embryo č. 3 (Obr. 6) bylo vyhodnoceno jako pravděpodobně normální a bylo doporučeno k embryotransferu. Embrya č. 1 (Obr. 4), 2 (Obr. 5), 4 (Obr. 7) a 5 (Obr. 8) byla vyhodnocena jako pravděpodobně abnormální, a nejsou tudíž doporučena k embryotransferu. V případě gravidity doporučujeme kontrolní prenatální vyšetření. Vyšetření nerozliší normální od balancované formy translokace. Metodou array CGH nemohou být zachyceny bodové mutace, balancované chromozomální aberace, nízkofrekvenční mozaika a změny pod rozlišovací schopností metody. Komplexní genetické změny – nalezeno tři a více genetických změn.
Provedli jsme retrospektivní analýzu na našem pracovišti a prezentovali jsme dvě kazuistiky z analyzovaného materiálu. Preimplantační genetické testování můžeme považovat za časnou formu prenatální diagnostiky, která umožňuje výběr a transfer zdravých embryí, předchází klasickou prenatální diagnostiku v probíhajícím těhotenství. Identifikace postižených embryí in vitro může být považována za přijatelnější než případné ukončení již probíhajícího těhotenství na základě výsledků prenatální diagnostiky, které není možné dříve než na konci prvního trimestru gravidity. Díky této diagnostice se mohou mnoha párům s rizikem závažného dědičného postižení narodit zdravé děti.