








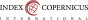

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Průlomová bolest (PB) je definována jako přechodné vzplanutí bolesti silné intenzity při dobře kontrolované základní bolesti analgetickou léčbou. Vyskytuje se u bolesti nádorového i nenádorového původu a dotaz na ni by měl být běžnou součástí každého kontaktu s pacientem. Ideálním řešením léčby je užití analgetika s rychlým nástupem účinku, snadno aplikovatelného a současně bezpečného pro pacienta. Článek uvádí přehled dostupných analgetik z každého stupně analgetického žebříčku WHO vhodných k léčbě PB a poukazuje na současné trendy léčby PB transmukózními formami fentanylu u onkologických pacientů.
Pojem průlomové bolesti (PB) je z praxe znám algeziologům a všem lékařům zabývajícím se léčbou bolesti. V poslední době je tato problematika diskutována zejména v onkologii v souvislosti s dostupností nových lékových forem fentanylu na našem trhu. V definici a názvosloví nebyla v České republice ani v zahraničí jasně stanovena pravidla, a proto byl vydán v roce 2011 Doporučený postup pro léčbu průlomové nádorové bolesti na podkladě společného stanoviska Společnosti pro studium a léčbu bolesti, České společnosti paliativní medicíny a České onkologické společnosti (1). Principy zde uváděné lze v praxi využít i pro léčbu průlomové bolesti nenádorového původu.
Průlomová bolest je definována jako přechodné vzplanutí intenzivní bolesti, které přichází spontánně nebo je vyvoláno působením specifického předvídatelného či nepředvídatelného faktoru i přes relativně stabilní kontrolu základní bolesti (Graf 1) (1).
PB je charakterizována rychlým nástupem, kdy je maximální intenzity bolesti dosaženo během několika vteřin až minut, a délkou trvání nejčastěji 30-60 minut. Frekvence PB může být velmi kolísavá, nejčastěji se pohybuje v rozmezí 2–4 epizod denně. Vyvolává u nemocných stavy úzkosti a deprese, nespokojenosti s léčbou a zvyšuje počet návštěv u lékaře. To se odráží i v oblasti ekonomiky zdravotnictví.
V oblasti onkologie jí trpí až 65 % pacientů (2). V ČR proběhl v roce 2010 dotazníkový projekt PARMA (Pain Relief Management) u onkologických pacientů (3). Celkem byla získána a zhodnocena data od 474 onkologických pacientů (4) s následujícími výsledky: průlomovou bolestí trpí více než 75 % pacientů užívajících pravidelně analgetika pro chronickou bolest, pacienti mají nejčastěji 2-3 epizody PB denně a trvání epizody je v průměru kolem 30 až 60 minut.
Na podkladě vyvolávající příčiny a předvídatelnosti lze rozlišit dvě základní kategorie PB (1,5):
1. Spontánní - vznikající náhle bez zjevné příčiny, nepředvídatelná.
2. Incidentální - spojená s určitou událostí, částečně předvídatelná. Rozlišují se tři subkategorie: bolest vyvolaná volní aktivitou (pohyb, defekace, příjem potravy, polykání), PB vyvolaná mimovolně (kýchnutí, peristaltika, škytavka) a PB procedurální (rehabilitace, převaz rány, radiologické vyšetření).
Z patofyziologického hlediska lze PB rozdělit na nociceptivní a neuropatickou. Nociceptivní bolest vzniká stimulací nocisensorů a je podkladem bolestí pohybového aparátu a vnitřních orgánů. V terapii se uplatňují analgetika žebříčku WHO (World Health Organisation) dle stupně bolesti.
Neuropatická bolest je generována centrálním nebo periferním nervovým systémem. V patofyziologii hrají důležitou roli centrální senzitizace, neuroplasticita a „wind up“ fenomén. Charakter bolesti je pálivý, bodavý, šlehavý, vystřelující, zhoršený v klidu a v noci.
Tato bolest je rezistentní na klasická analgetika a v terapii je třeba použít adjuvantní léčiva (koanalgetika): antiepileptika, tricyklická antidepresiva, kortikosteroidy a lokální anestetika.
Samotný charakter neuropatické bolesti bývá v praxi někdy omylem považován za průlomovou bolest. Ke správnému nastavení medikace je důležitá pečlivá anamnéza a cílené kontrolní dotazy na PB.
U onkologických pacientů (při prorůstání nádoru do nervových struktur) se vyskytuje často bolest smíšená, která zahrnuje složku nociceptivní i neuropatickou. Zde je nutná kombinace klasických analgetik a koanalgetik.
Patofyziologický charakter PB obvykle souvisí se základní chronickou bolestí daného pacienta. Na podkladě studie (6) bylo zastoupení jednotlivých typů PB následující: somatická 33 %, viscerální 20 %, neuropatická 27 % a smíšená 20 %.
Pokud je vedena léčba bolesti chronického pacienta, který má nastavenou bazální hladinu dlouhodobě působícího analgetika, je nutné dotaz na PB zařazovat do každé kontroly. Bolest je obecně definována podle Mezinárodní společnosti pro studium a léčbu bolesti jako nepříjemný senzorický a emocionální prožitek spojený se skutečným nebo potenciálním poškozením tkáně nebo popisovaný výrazy pro takové poškození. Bolest je vždy subjektivní. Její intenzita závisí na individuálním prahu bolesti, psychickém stavu, hormonální rovnováze a sociálním prostředí pacienta. K objektivizaci a hodnocení PB se využívají škály bolesti - nejčastěji vizuální analogová (VAS – visual analogue scale), numerická (NPRS – numeric pain rating scale), obličejová a záznamů v deníku bolesti. V ideálním případě tak pacient zapisuje do deníku intenzitu bolesti 3–5x denně a výskyt epizod průlomové bolesti. Přínosné je také zaznamenávat situace s objektivními příčinami, které k PB vedou a užitou medikaci.
K nastavení efektivní léčby je třeba souhrnně vyhodnotit etiologii, patofyziologický typ, intenzitu, nástup a trvání, frekvenci, charakter, lokalizaci a propagaci bolesti, doprovodné symptomy, vyvolávající faktory a reakce na dříve podávaná analgetika.
U onkologických pacientů je nutné využít v léčbě všech dostupných a účinných postupů jako jsou radioterapie, bisfosfonáty a operační stabilizační postupy. K důležitým faktorům, které mohou zlepšit bolestivý stav, patří i protetické pomůcky, vhodně upravené lůžko, aplikace pomocných léčiv (antitusika, laxativa) a zejména psychoterapie (3).
Pravidelnou medikaci chronické bolesti je třeba upravit tak, aby byla základní bolest většinu dne dostatečně zmírněna. Podle charakteru této základní bolesti přidáváme koanalgetika. Maximální dávku opioidu je třeba nastavit tak, aby míra nežádoucích účinků byla ještě na přijatelné úrovni (1).
V rámci každé kontroly je nutné hodnotit počet denních epizod PB a vybavit každého ambulantního pacienta i analgetikem k řešení těchto atak, tzv. záchrannou (rescue) medikací.
Podání záchranné medikace vychází ze zkušenosti, že krátkodobé epizody vzestupu intenzity bolesti je možné řešit včasným podáním krátkodobě rychle působícího analgetika. Hlavními požadavky na tuto medikaci jsou:
V případech předvídatelného výskytu PB se farmaka aplikují asi 30 minut před vyvolávající událostí. Pokud se vyskytují více než 4 epizody PB denně, měla by se zvážit efektivnost bazální dávky dlouhodobě působícího opioidu a případně dávka navýšit.
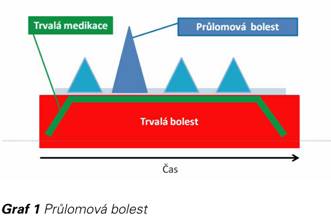
Výběr analgetika volíme podle intenzity bolesti a analgetického žebříčku WHO (Tab. 1).
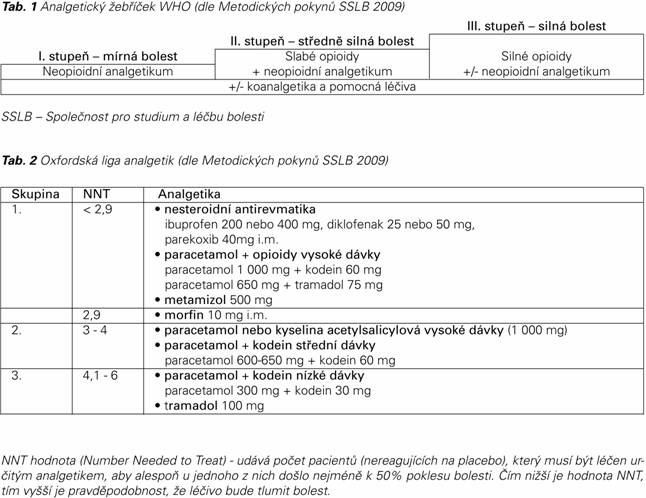
U silné PB nereagující na předchozí léčbu je třeba užít dostupná analgetika 3. stupně, to platí zejména pro PB u onkologických pacientů. K porovnání farmak podle analgetické potence slouží také Oxfordská liga analgetik (Tab. 2). Jde o žebříček analgetik sestavený podle jejich NNT hodnot určených na základě výsledků nezávislých metaanalýz četných klinických studií o působení analgetik u akutních bolestí u dospělých. Tyto studie, prováděné z hledisek medicíny založené na důkazech, jsou komerčně nezávislé. Podle Oxfordské ligy analgetik mají u akutní bolesti nejvyšší pravděpodobnost analgetického účinku (nejnižší NNT) nejen silné opioidy, jako morfin, ale i nesteroidní antiflogistika/antirevmatika, kombinace paracetamolu s opioidy podané ve vysokých (ale ještě přípustných) dávkách a metamizol. I když má Oxfordská liga analgetik určité meze (měří pravděpodobnost, spíše než vlastní intenzitu analgetického účinku, vychází z akutní bolesti a jednorázové aplikace), získala si rychle velkou autoritu.
Vhodná léková forma analgetika se volí vždy podle aktuálního zdravotního stavu pacienta a v ideálním případě na základě domluvy pacienta s lékařem. Důležitá pro rychlost nástupu analgetika je také jeho léková forma. U hospitalizovaných pacientů je nejrychlejší cestou podání parenterální. V ambulantní sféře to jsou tablety efervescentní a dispergovatelné, léčiva ve formě kapek a transmukózní systémy.
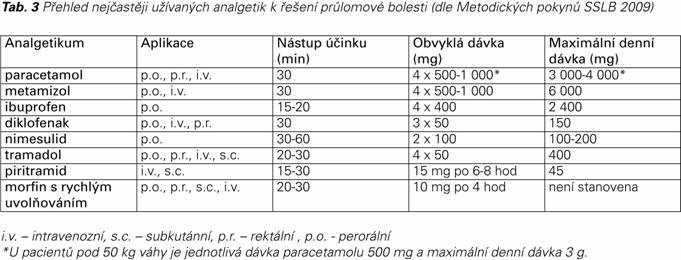
Intenzita průlomové bolesti určuje výběr analgetika z řad opioidů nebo zástupců neopioidní řady. Nejčastěji užívaná analgetika a jejich dávkování je uvedeno v tabulce 3.
Paracetamol má příznivý bezpečnostní profil, a proto představuje lék první volby u geriatrických pacientů. Svým rychlým nástupem je vhodný i k řešení průlomové bolesti. U předvídatelné PB je racionální jeho podání asi 30 min před plánovanou aktivitou. Velkou výhodou paracetamolu, ve srovnání se salicyláty a jinými NSA, je nepřítomnost gastrointestinální toxicity, která nezvyšuje riziko GIT krvácení. Poškození jater po terapeutických dávkách paracetamolu je výjimečné a přichází v úvahu spíše při stavech s nízkými hladinami glutathionu, jako jsou kachexie při anorexii, hepatitida C a cirhóza jater (7). Injekční forma má své místo v léčbě PB u hospitalizovaných pacientů. Rychlost nástupu analgetického účinku se udává 5–10 minut, na základě praktických zkušeností je zaznamenávána doba delší (až 30-45 minut).
Z nežádoucích účinků metamizolu je znám jeho negativní vliv na krvetvorbu. Poslední epidemiologické studie ukazují, že toto riziko je velmi nízké (1:1 000 000). Agranulocytóza bývá reverzibilní a jejími klinickými projevy jsou horečka a pharyngitis (8). Je třeba se však obávat vzácné, ale těžké anafylaktoidní reakce, kterou tento lék může vyvolat. Proto by neměl být podáván u astma bronchiale a polyvalentních alergiků. Intravenózní forma je běžně využívána k řešení PB u hospitalizovaných pacientů. Kombinace metamizolu se spazmolytikem pitofenonem představuje účinnou léčbu u bolestí břicha, je dostupná v intravenózní i kapkové formě.
Nesteroidní antirevmatika (NSA) představují silná analgetika a pro svůj volný prodej také velmi oblíbená, zároveň vyžadují opatrnost z důvodů významných nežádoucích účinků. Podle svého působení na cyklooxygenázu 1 a cyklooxygenázu 2 je dělíme na specifické COX 1 inhibitory (KAS – kyselina acetylsalicylová), neselektivní COX inhibitory - klasická NSA (ibuprofen, diklofenak, indometacin), preferenční COX 2 inhibitory (nimesulid, meloxicam) a COX 2 selektivní inhibitory - koxiby (parekoxib, etorikoxib, celekoxib). Je třeba zdůraznit, že klasická NSA jsou farmaka pro dlouhodobé podávání naprosto nevhodná z důvodu svých závažných nežádoucích účinků na gastrointestinální systém (GIT), kardiovaskulární systém, trombocyty a ledviny. Nadužívání klasických NSA vede ke klinickým jednotkám známým jako NSA indukovaná gastropatie, NSA enteropatie a kolopatie. Rizikovou skupinu představují pacienti nad 65 let věku, s chronickou kortikoterapií, warfarinizací a pozitivní GIT anamnézou. Pro svůj silný analgetický potenciál mají NSA své místo u onkologických pacientů k řešení PB, kde se nepředpokládá jejich dlouhodobé užívání a léčba je řešena symptomaticky. K prevenci NSA gastropatie je nutno ale podávat inhibitory protonové pumpy. H 2 blokátory se jeví v tomto případě jako neúčinné.
K řešení průlomové bolesti jsou vhodná zejména NSA s krátkým poločasem a to ibuprofen a diklofenak. Diklofenak je u nás také dostupný v intravenózní formě.
Nimesulid s rychlým nástupem účinku je doporučován SÚKLem používat v dávkování 200 mg denně (2 tbl) pouze po dobu 2 týdnů. Při delším podávání se může projevit jeho hepatotoxicita. Oblíbená je i jeho aplikace ve formě rozpustného granulátu, kterou lze užít i bez potřeby vody.
Užití tramadolu je rozšířeno pro svou rozmanitou škálu lékových forem vhodných k řešení akutní i chronické bolesti. K léčbě PB se nabízí tramadol ve formě kapek, effervescentní tablety a během hospitalizace intravenózního podání. Nejčastějšími nežádoucími účinky jsou nauzea a zvracení na počátku léčby a výskyt zácpy při dlouhodobém podávání. K řešení těchto problémů se využívá kombinace s antiemetiky a laxativy.
Pro léčbu PB je svým rychlým nástupem vhodná další léková forma – orálně dispergovatelná tableta (ODT) tramadolu. Tato forma je definována jako neobalená tableta, která po vložení do úst rychle disperguje, ještě před jejím spolknutím. Evropský lékopis používá názvu pro lékovou formu rozpadající se v dutině ústní bez potřeby vody či žvýkání (9). Rozpad tablety je ukončen během několika sekund po jejím vložení do úst. Tyto tablety je třeba odlišovat od orálních pastilek a tablet sublinguálních, bukálních a žvýkacích. Přesně definovaná jednotlivá dávka zabraňuje předávkování pacientů, ke kterému často snadno dochází používáním kapkových forem. Dispergovatelná tableta rozšiřuje možnost podání u osob, pro které byly dosavadní formy nepřijatelné, zejména u pacientů s dysfagií. Potíže s polykáním (dysfagie) má 35 % populace, zejména pacienti z řad seniorů (35–40 %) a 18–22 % nemocných v dlouhodobé péči. Nejčastějšími diagnózami jsou centrální mozkové příhody, parkinsonismus, AIDS, stav po chirurgických výkonech a radiační terapii v oblasti hlavy a krku (převaha onkologických pacientů) (10). Praktické uplatnění nachází ODT také u osob které mají častou nauzeu, zvrací nebo trpí nevolností a u seniorů, dětí a u „cestujících“ pacientů, kteří nemají možnost požití tekutiny.
Oxfordská liga analgetik přinesla přesvědčivý doklad toho, že kombinace slabých opioidních analgetik (kodeinu, tramadolu) s paracetamolem má výhodný aditivní až synergický efekt a významně vyšší analgetickou účinnost, než když jsou tyto látky podány samotné (11).
Za zmínku stojí kombinace paracetamolu s kofeinem a kodeinem v effervescentní formě s rychlým nástupem účinku. Kombinace paracetamolu s tramadolem, rozšířená také již v rozpustné formě, je vhodná pro léčbu PB u pacientů v kombinaci se silnými opioidy, v případě kontraindikace NSA a u seniorů. Tato kombinace zaručuje vyšší analgetické působení za současného snížení toxicity a výskytu nežádoucích účinků tramadolu. Doporučená první dávka jsou 2 tbl, které vykazují silnou analgetickou potenci podle Oxfordské ligy analgetik, srovnatelnou s NSA a morfinem. Praktické zkušenosti u seniorů uvádějí startovací dávku jednou tabletou, a pokud nedojde do 30 minut k úlevě, lze užít druhou tabletu.
U velmi silné průlomové bolesti, se kterou se setkáváme hlavně u nádorových onemocnění, je nutno užít silné opioidy. Zlatým standardem zůstává nejen v naší republice, ale i celosvětově morfin z důvodů své ceny a největší zkušenosti s jeho používáním. Pro ambulantní pacienty je dostupný v tabletové formě (tbl 10 mg, 20 mg) nebo ho lze předepsat ve formě kapek:
Morphini hydrochlorici 1.0 (gramma unum)
Spiriti vini
Sirupi auranti
Aquae destilatae aa ad 100,0
M.D.S. při bolesti 20 kapek = 10 mg morfinu
U hospitalizovaných pacientů lze morfin u PB řešit subkutánním (s.c.) nebo intravenózním (i.v.) podáním za dodržení intervalu 4 hodin mezi jednotlivými dávkami.
Další možnost představuje piritramid, který se aplikuje subkutánně nebo pomalou infuzí po 6–8 hodinách. Používání dříve rozšířeného pethidinu se z důvodu krátké doby působení a vzniku toxického metabolitu norpethidinu nedoporučuje.
Ostatní silné opioidy v intravenózní aplikaci patří do rukou anesteziologů za trvalé monitorace dechových a oběhových funkcí. Podle nejnovějších doporučení a zásad se zcela upouští od intramuskulární aplikace farmak a upřednostňuje se podání subkutánní. Důvodem je narůstající počet soudních sporů spojených s komplikacemi při intramuskulární aplikaci (poranění nervů, abscesy), nepředvídatelná absorpce léčiva u obézních a bolestivá aplikace (12).
Fentanyl řadíme mezi silné opioidy, čisté agonisty μm-opioidních receptorů. Fentanyl citrát je silně působícím opioidním analgetikem, přibližně 50–100krát dávkově potentnějším než morfin. Je vysoce lipofilní, podléhá metabolismu prvního průchodu játry, může se velmi rychle absorbovat ústní sliznicí a pomaleji konvenční gastrointestinální cestou. Tyto vlastnosti prakticky znemožňují jeho podání v perorálních lékových formách. Z tohoto důvodu je k dispozici pouze k parenterální aplikaci v anesteziologii a intenzivní péči a transdermální systémy fentanylu se běžně používají v algeziologii k řešení chronické bolesti. V současné době jsou registrovány a dostupné moderní transmukózní formy s rychlým nástupem účinku: intranazální sprej, sublinguální tableta a bukální aplikace ve formě tablety a filmu (Tab. 4). Indikací těchto léčiv je léčba PB pouze u opioid-tolerantních onkologických pacientů (pacient užívající opioid ekvivalentní denní dávce 60 mg morfinu).
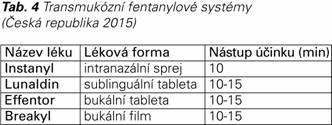
Intranazální fentanyl (Instanyl) má na podkladě klinických studií velmi rychlý klinicky významný nástup účinku (10 min) (13). Jeho velkou výhodou je snadná aplikace a možnost podání i u pacientů s xerostomií a s mukozitidou. Mezi nejčastější nežádoucí účinky patří ospalost, závratě, bolest hlavy, zčervenání, návaly horka, podráždění v hrdle, nevolnost, zvracení a hyperhidróza. Jeho užívání vyžaduje intaktní nosní sliznici a kontraindikací podání jsou stavy po radioterapii obličeje a opakované epizody epistaxe.
Nástup klinicky významného analgetického účinku sublinguálního fentanylu (Lunaldin) je 10–15 minut. Tableta se skládá z nosiče, účinné látky a mukoadhezivní složky, která po rozpadu tablety na předem definované jednotky umožní přilnutí těchto jednotek na sliznici, aby nedošlo k polknutí účinné látky (14). K rozpadu tablety dochází během několika sekund. Praktické využití této formy je vhodné v případech, kde trpí pacient výraznou suchostí sliznic a tam, kde preferuje užití tablet.
U bukální tabletové formy (Effentora) závisí schopnost průniku fentanylu sliznicí dutiny ústní na pH okolního prostředí. Přechodné změny pH doprovázející efervescentní reakci mohouoptimalizovat rozpouštění (při nižším pH) a průnik membránou (při vyšším pH). Léková forma při styku se slinami ústní dutiny snižuje dočasně pH, čímž se fentanyl rychle rozpouští a uvolňuje. Následné uvolnění CO2 okolní pH zvyšuje, což vede ke snadnému prostupu membránami (16). Statisticky významné zlepšení v rozdílu intenzity bolesti oproti placebu bylo pozorováno již po 10–15 minutách (16,17). Jakmile je jednou tableta vystavena působení vlhkosti, začne se rozpouštět, a tím dochází k uvolnění léčivé látky. Proto je třeba po vyjmutí z blistru tabletu okamžitě vložit do horní části dutiny ústní (nad horní zadní stoličku a dáseň) a na tomto místě ji udržet po celou dobu rozpadu tablety, to je 14-25 minut. Preparát se nesmí cucat, žvýkat ani polykat, protože by to mělo za následek nižší koncentrace v plazmě. Během aplikace není dovoleno pít a jíst. Přibližně po 30 minutách, pokud ještě zůstanou zbytky léčiva v ústech, je možné je spolknout a zapít sklenicí vody (18). U pacientů s xerostomií je nutné, aby se před podáním napili vody za účelem zvlhčení dutiny ústní. Pokud toto doporučení nevede k odpovídajícímu šumění, může být nutný přechod na jinou terapii.
Prostupnost fentanylu sliznicí dutiny ústní využívá také další přípravek ve formě bukálního filmu (Breakyl). Při jeho aplikaci má pacient jazykem navlhčit vnitřní stranu tváře nebo vypláchnout si ústa vodou ke zvlhčení místa, kam bude lék umístěn. Růžová strana obsahující fentanyl je určena k aplikaci na sliznici, bílá strana minimalizuje uvolňování fentanylu do slin, aby se zabránilo polknutí léčivé látky. Film je třeba stlačit a držet na místě minimálně 5 vteřin, dokud pevně nepřilne. Během 15–30 minut se přípravek zcela rozpustí (19).
Jestliže se přechází z jiného fentanyl citrátového přípravku, je nutná nezávislá titrace nové formy z důvodu odlišné biologické dostupnosti jednotlivých přípravků. Obecně platí pro všechny formy TMF následující pravidlo: dávka transmukózního fentanylu je individuální, musí se na začátku léčby titrovat a nelze ji odvodit z celkové denní dávky opioidu, který pacient užívá pro kontrolu základní bolesti (20).
Koanalgetika primárně nepatří mezi analgetika, ale svými účinky příznivě ovlivňují vedení bolesti nervovými vlákny. Bývají také označována jako modulátory bolesti. Pokud je na základě anamnézy a charakteru bolesti uvažováno o neuropatické bolesti, jsou tato farmaka běžnou součástí léčby. Ataky šlehavých, bodavých nebo vystřelujících pocitů, které mohou být zaměňovány za PB, jsou tlumeny užíváním koanalgetik v pravidelných intervalech. Lékem první volby u neuropatické bolesti jsou antiepileptika (gabapentin, pregabalin) a tricyklická antidepresiva (amitriptylin) (21).
Antiepileptika snižují spontánní neuronální výboje účinkem na iontové kanály nebo neurotransmitery a mohou tak mít obdobný efekt na abnormální výboje bolestivých vláken. Indikací pro jejich podání je bodavý, píchavý, lancinující nebo vystřelující charakter bolesti. U gabapentinu se začíná dávkou 300 mg na noc (v geriatrii 100 mg) a opatrně se v průběhu několika dnů až týdnů podle snášenlivosti titruje do analgeticky účinné dávky. Denní dávkovací rozmezí je 900–3 600 mg, rozdělené do 3 dávek. Gabapentin je velmi dobře tolerován, mezi nejčastější nežádoucí účinky patří somnolence, závratě a někdy ataxie. Jednou z výhod pregabalinu oproti gabapentinu je výborná biologická dostupnost (bioavailability), takže nevyžaduje delší titrační období. Příznivě ovlivňuje i poruchy spánku a deprese. V psychiatrii je indikován k terapii afektivně úzkostné poruchy. Podle efektu a tolerance se užívá 50-600 mg/den, ve 2 denních dávkách. Má poměrně více nežádoucích účinků, z nichž nejčastější jsou: sucho v ústech, poruchy vidění, ospalost, otoky (zejména periferní), přírůstek hmotnosti. Nově (jaro 2015) je i u nás dostupná 50mg tableta, která umožňuje pomalou titraci u starších osob.
Pálivý a šlehavý charakter bolesti je důvodem podání tricyklických antidepresiv. Mechanizmus jejich analgetického účinku spočívá v potenciaci noradrenergní a serotoninergní neurotransmise na úrovni descendentního tlumivého systému míšního. Hlavním zástupcem je amitriptylin. Začíná se opět malými dávkami 25 mg na noc pro jeho tlumivý účinek až do maximální analgetické dávky 150 mg/den. Jeho podání je kontraindikováno u pacientů s kardiologickou anamnézou (arytmogenní účinek), s glaukomem a v kombinaci s IMAO (inhibitory monoamonioxidázy). U pacientů s onemocněním kardiovaskulárního aparátu bývá lépe tolerován nortriptylin.
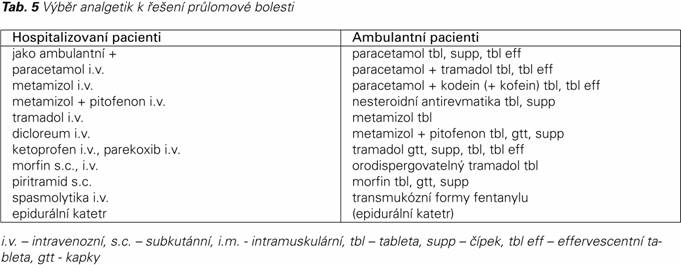
Tabulka 5 podává přehled analgetik s rychlým nástupem účinku s ohledem na jejich cesty podání. Je třeba zdůraznit, že pro ambulantní léčbu se jednoznačně preferuje neinvazivní podávání s výjimkou aplikace do epidurálního katetru.
Invazivní postupy mají své místo v léčbě PB v případech, kde selhává běžná farmakoterapie. Nejčastěji se jedná o onkologické pacienty, ale jsou účinné i u pacientů s bolestmi nenádorové etiologie. Zvažují se i u stavů s postižením pohybového systému k usnadnění rehabilitace. V praxi se využívají katetrové techniky v oblasti epidurálního prostoru nebo periferních nervů. V těchto případech je nutná spolupráce s anesteziology, titrace účinné dávky lokálního anestetika a opioidu je vhodná za hospitalizace. Nejčastěji podáváným lokálním anestetikem je bupivakain a levobupivakain, z opioidů se podává morfin, sufentanil nebo fentanyl. Po důkladné edukaci pacienta a rodiny je možná aplikace i v domácím prostředí. Nevýhodou těchto metod je vznik tolerance na léčbu, dislokace katetru a možné infekční komplikace.
Ideální možnost léčby PB představuje pacientem kontrolovaná analgezie (PCA) u periferních a centrálních blokád nebo intravenózní aplikace, kde je možné bolusem „on demand“ (podle potřeby) navýšit analgezii. Na rozdíl od ostatních evropských zemí není tato metoda u nás zatím z ekonomických důvodů plně rozšířená.
Průlomová bolest zasahuje velmi negativně do kvality života pacientů a měla by být úspěšně tlumena. Dotaz na ni a její monitorace se stává samozřejmostí v kontaktu s nemocnými. Farmaceutické firmy vyvíjejí nové preparáty v této oblasti a sledování tohoto trendu patří k běžnému postgraduálnímu vzdělávání lékařské veřejnosti.